リサンキズマブ、活動性潰瘍性大腸炎に対する第3相寛解導入療法試験で主要評価項目達成
ニュース | 2023/4/27
日本では活動期クローン病などの治療薬として承認済みだが、潰瘍性大腸炎では未承認
米アッヴィ社は4月24日、中等症~重症の活動性潰瘍性大腸炎を有する成人患者さんを対象とした第3相寛解導入療法試験(INSPIRE試験)において良好なトップライン結果が得られ、0週、4週、8週時にリサンキズマブ1,200mgを静脈内投与したグループ(リサンキズマブ群)が、主要評価項目である12週時の臨床的寛解および全ての副次評価項目を達成したことを発表しました。
リサンキズマブは、IL-23を選択的にブロックするIL-23阻害薬。IL-23は炎症に関与するタンパク質で、クローン病を含む多くの慢性免疫関連疾患に関連すると考えられています。同剤はクローン病、尋常性乾癬、乾癬性関節炎(関節症性乾癬)の治療薬として、米国食品医薬品局(FDA)および欧州医薬品庁(EMA)より承認されました。現在、クローン病、潰瘍性大腸炎、乾癬、乾癬性関節炎(関節症性乾癬)を対象とする第3相試験が進行中です。
日本において同剤は、中等症~重症の活動期クローン病、既存治療で効果不十分な尋常性乾癬、関節症性乾癬(乾癬性関節炎)、膿疱性乾癬、乾癬性紅皮症に対する治療薬として承認されていますが、本文中にある潰瘍性大腸炎の適応症は承認されていません。
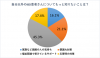
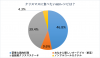
臨床的寛解20.3%、内視鏡的改善36.5%、組織学的・内視鏡的粘膜改善24.5%
INSPIRE試験は、既存治療や先進治療(生物学的製剤、JAK阻害薬およびS1P受容体モジュレーター)で不耐容または効果不十分だった患者さんを対象とした試験です。
同試験において12週時の臨床的寛解を達成した患者さんの割合は、リサンキズマブ群で20.3%だったのに対し、プラセボを投与したグループ(プラセボ群)では6.2%であり、統計学的に有意な改善を示しました。
また副次評価項目について、12週時に内視鏡的改善を達成した患者さんの割合は、プラセボ群で12.1%だったのに対し、リサンキズマブ群では36.5%、さらに、12週時に組織学的・内視鏡的粘膜改善を達成した患者さんの割合は、リサンキズマブ群の24.5%に対し、プラセボ群では7.7%となり、どちらも有意な改善が見られました。
同社は「今回の結果は、リサンキズマブが腹痛、便意切迫、便失禁などの潰瘍性大腸炎の困難な症状に患者さんが対処する際の助けになり得ることを示唆している」と、述べています。
(IBDプラス編集部)